化学と生物学の融合により
生命科学の解明・医療・環境改善に貢献する
未だ混沌とした「生命」の謎を紐解く方法として、生命現象を「化学物質の分子レベルの反応と連携」と捉えて、化学の言葉で理解するケミカルバイオロジーが注目されています。さらに、生命の謎解きに留まらず、生命に積極的に働きかけ、人々の健康と医療に貢献するものづくり、生体システムを模倣・活用することで環境にやさしいバイオミメティック合成などの研究も重要となっています。この研究分野では、細胞内シグナル伝達系の解明やその阻害剤の開発、生体分子と特異的に結合し生物活性を発現する生体機能分子のデザイン、多様で豊かな機能を有するソフトマテリアルの創製と医用高分子材料の開発などに取り組んでいます。
バイオサイエンスの研究例
がん細胞悪性化に関与する糖鎖修飾の解析と血管擬態の研究
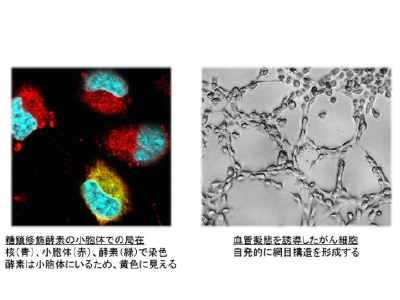
タンパク質の中には翻訳後に様々な糖が付加し活性などに影響が出る場合があります。これは、「タンパク質糖鎖修飾」という酵素反応で、主に分泌タンパク質でよく起こり、なかにはがん細胞の悪性化に関与しているものもあります。写真左は、その酵素が小胞体で機能していることを示したものです。また、がん細胞自体が血管のような形態に変化する「血管擬態」という現象があり、がんの増殖に寄与していることが示唆されています。写真右は血管擬態を起こした細胞集団で、がん細胞が血管のように網目状の構造体になっています。分子生物学や生化学的な解析を通してこれらの現象を明らかにし、生物学・医学の分野での応用を目指しています。
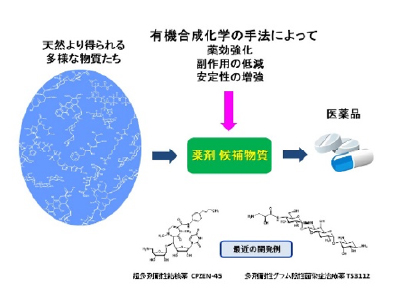
天然化合物が有する生物活性評価および作用機序解析
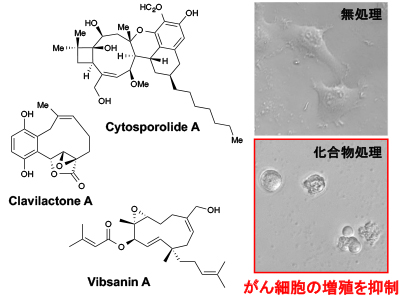
微生物や植物などが作り出す天然化合物には、ヒトに対して様々な生物活性を有する化合物が数多くあり、実際にこれら化合物から抗生物質や抗がん剤などの優れた医薬品が開発されています。写真左は、微生物や植物などから単離されたいくつかの天然化合物です。これら化合物をヒト由来のがん細胞に投与すると写真右のように、がん細胞の増殖が抑制される現象が起こります。そこで、この現象について化学的手法を用いて生物学を研究する学問領域であるケミカルバイオロジーにより、化合物がどのようなメカニズムでがん細胞の増殖を抑制しているかなどの解析を行い、これら化合物を医薬品へと展開することを目指しています。
有機合成化学を駆使した新しい感染症治療薬の創製
人類は抗菌薬の発明により病原菌を克服できるかに思われましたが、今、細菌側の種類を超えた耐性獲得という反撃によって、再び劣勢に立たされようとしています。この薬剤耐性は人類の公衆衛生や世界経済にとって大きな脅威と捉えられており、各国が協調して対策に取り組もうとしています。私たちは感染症治療のための新しい候補物質を自然界、とりわけ微生物が産生する多くの多様な物質群の中から見つけ出し、その分子構造を基盤に有機合成化学の手法を駆使して新しい物質を創造することで、薬剤耐性問題に対応可能な医薬品の創製に取り組んでいます。最近の創薬例には、超多剤耐性結核薬や多剤耐性グラム陰性菌感染症薬などがあります。
標的とした生体高分子を光分解する生体機能光制御分子の創製
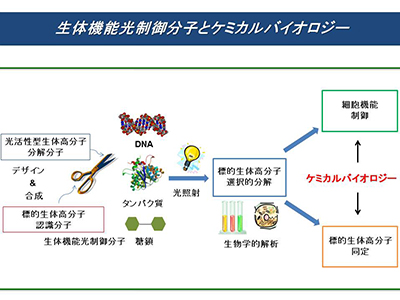
DNA、タンパク質、糖鎖は、生体高分子として、生命活動のために重要な働きをしています。したがって、これら生体高分子の機能を精密に制御することは、生体機能を制御する上で重要です。本研究では、標的とした生体高分子だけを正確に認識・識別、光照射をすることによって、標的とした生体高分子のみを光分解し、目的の細胞機能を制御する分子のデザイン・合成・機能評価を行っています。このためには、化学のみならず、生物学の知識と技術が必要であり、これらが融合したケミカルバイオロジーを展開しています。また、このような生体機能光制御分子は、種々の病気を副作用なく治療する新しい薬剤として注目され、更なる発展が期待されています。
生物活性糖質の理解・活用・制御を目指したケミカルバイオロジー研究
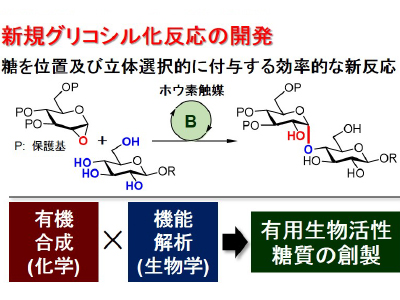
核酸およびタンパク質に次ぐ、第三の生体高分子である糖質は、様々な病気や生命現象に深く関わっており大変重要です。そのため、天然生物活性糖質の機能解明とこれらの機能を人為的に制御する新しい技術開発が強く求められています。そこで私たちは、有機化学を柱とした“有機合成(ものづくり)”と生物学を柱とした“機能解析”を融合し、有用生物活性糖質の理解・活用・制御を目指した研究を行っています。本研究の推進により、糖質を標的とした新たな予防・診断・治療薬の開発が期待できます。図には、最近私たちが開発した新しいグリコシル化反応の一例を示しており、本反応を活用した有用生物活性糖質の創製研究を展開しています。
小さな世界のものづくりを可能にするポリマー・アトリアクター
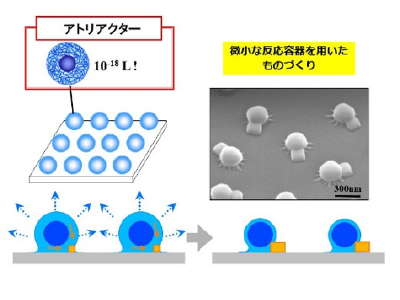
コアシェル型微粒子は図の左上に示すように硬質のコアと溶媒を含んだ高分子鎖からなるシェルで構成されています。シェルは溶液を吸収して膨潤し、乾燥により収縮します。シェルの容量はアトリットル(10-18L)オーダーと超微量です。この微小なシェル部をアトリットルスケールの反応場と考えると、その中で小さなマテリアルを作製することができます。これはDNAの複製、タンパク質合成など生体内で行われている「ものづくり」と同じようなスケールです。電子顕微鏡の写真は、微粒子に食塩水溶液を含ませて、ゆっくりと乾燥させたものです。ひとつひとつの微粒子から小さな食塩の結晶が生まれています。
生体膜の観点からデザインした生体親和性ナノカプセルの創製
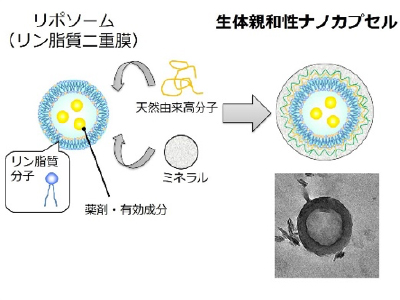
人工的に細胞の形質膜とよく似た脂質二分子膜を得ることができます。これは、「リポソーム」と呼ばれるナノサイズの中空体で、脂質間の分子間力により脂質が集積して形成されたものです。このようなリポソーム表面に様々な装飾を施すことで、機能性ナノカプセルを作製することができます。写真は、リポソーム表面に生体高分子(ポリペプチド、多糖など)とリン酸カルシウムを積層化させたナノカプセルです。全て天然由来素材から構成されているため、生体親和性と生分解性に優れています。また、内部に微小な空間を有するため、薬剤など有効成分を保持・保護し、体内で患部にまで送り作用させる薬物送達キャリアとしての応用が期待できます。