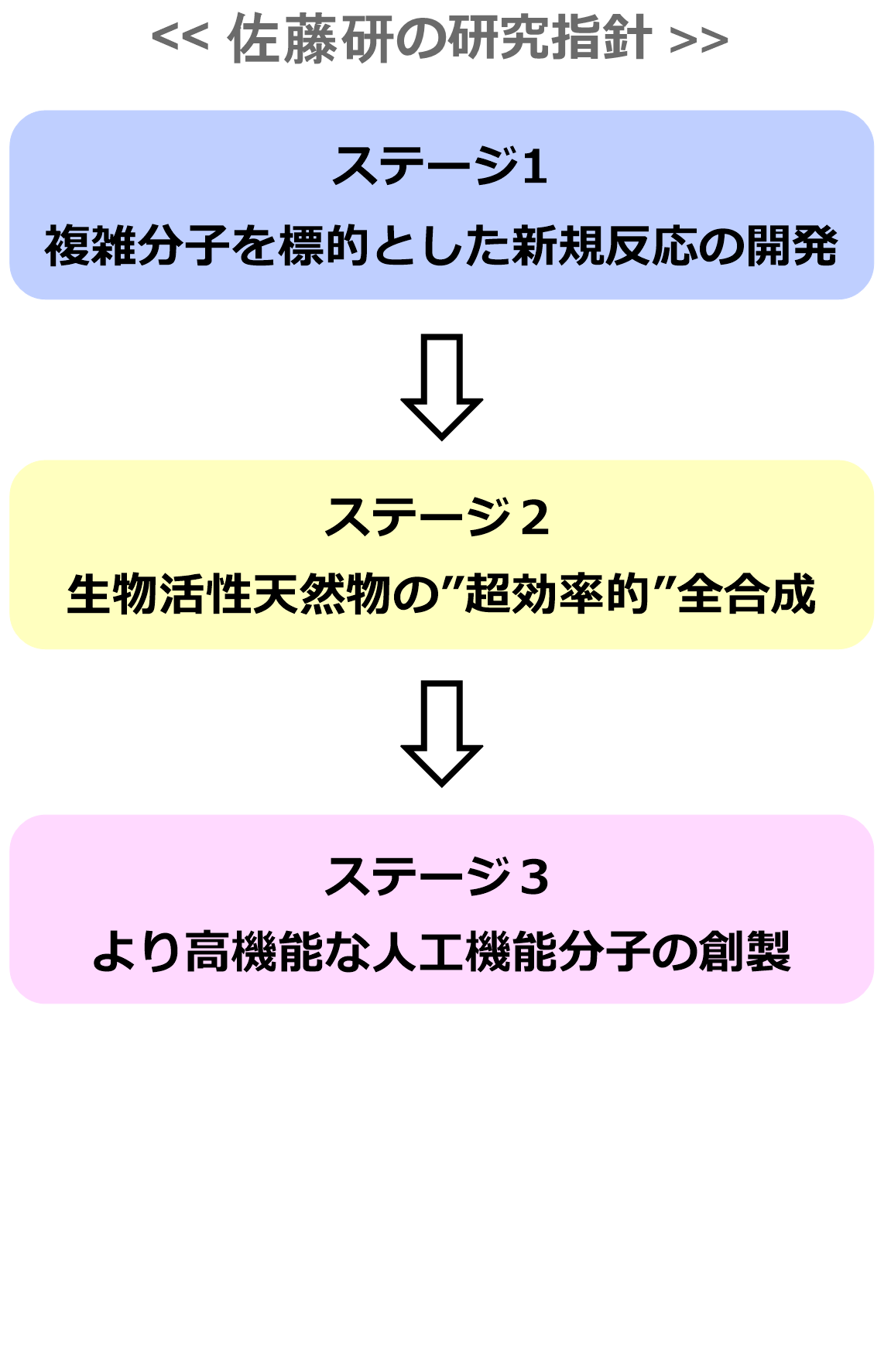
研究主題
佐藤研究室の研究テーマ方針
有機合成化学は、私たちの生活に不可欠である医薬品や機能材料など様々な化合物を供給してきた化学の中枢を担う学問領域です。現在、その有機合成化学が国際的な変革の時を迎えています。合成により供給が望まれる有機化合物の分子構造が急激に複雑化しているためです。抗がん剤や神経変性疾患治療薬など、構造が複雑化している医薬品候補分子の供給が、既存の反応・方法論の組み合わせでは解決できません。このような背景のもと、佐藤研究室では3つのステージで研究に取り組んでいきます。
これまで、何千何万という有機反応が報告されてきました。しかし、たくさんの官能基を分子内に有する複雑分子に対して利用できる反応となると、その数は非常に限られています。私たちの研究室では、全合成の効率化に必要な反応は、自ら開発するという基本姿勢で、複雑な化合物に適用できる合成反応を開発しています。
2)第2ステージ:複雑な構造を有する生物活性天然物の”超効率的”全合成
創薬化学の分野では、分子量の小さな比較的構造が単純な分子(低分子)では薬になりにくいことが明らかになってきました。一方、多数の官能基を有する天然物は、生体内のタンパク質や核酸などと多点相互作用が可能なため、すぐれた医薬品候補として期待されています。しかし、その複雑な構造のため実践的な供給が難しく、創薬研究の足かせになっているのが現状です。佐藤研究室では、自ら開発した新規反応を用いて、生物活性天然物の全合成の革新に挑んでいます。
2)第3ステージ:より高機能な人工分子の創製
有機合成化学者の強みとして、天然に存在するものだけでなく、自分の望む化合物をデザイン・合成できる点があげられます。開発した方法論・全合成戦略を活かし、他の科学者では供給できない優れた人工分子の創製を目指します。
研究例1. アミド基変換反応の開発と天然物合成への応用
アミド基は、我々の日常生活に不可欠である医薬品など様々な分野において、重要な役割を果たす官能基です。このため、有機合成化学者は効率的にアミド基を作る反応を重点的に開発してきました。一方、生じたアミド基の変換反応は、その非常に高い安定性のために過激な反応条件が不可欠であり、これまで見過ごされてきた研究分野でした。私たちは、安定なアミド基を合成中間体とし、合成終盤でアミド基選択的に多置換アミンに変換する合成戦略のもと、実用的なアミド基変換反応の開発と、これを用いた生物活性アルカロイドの全合成の革新に取り組んでいます。
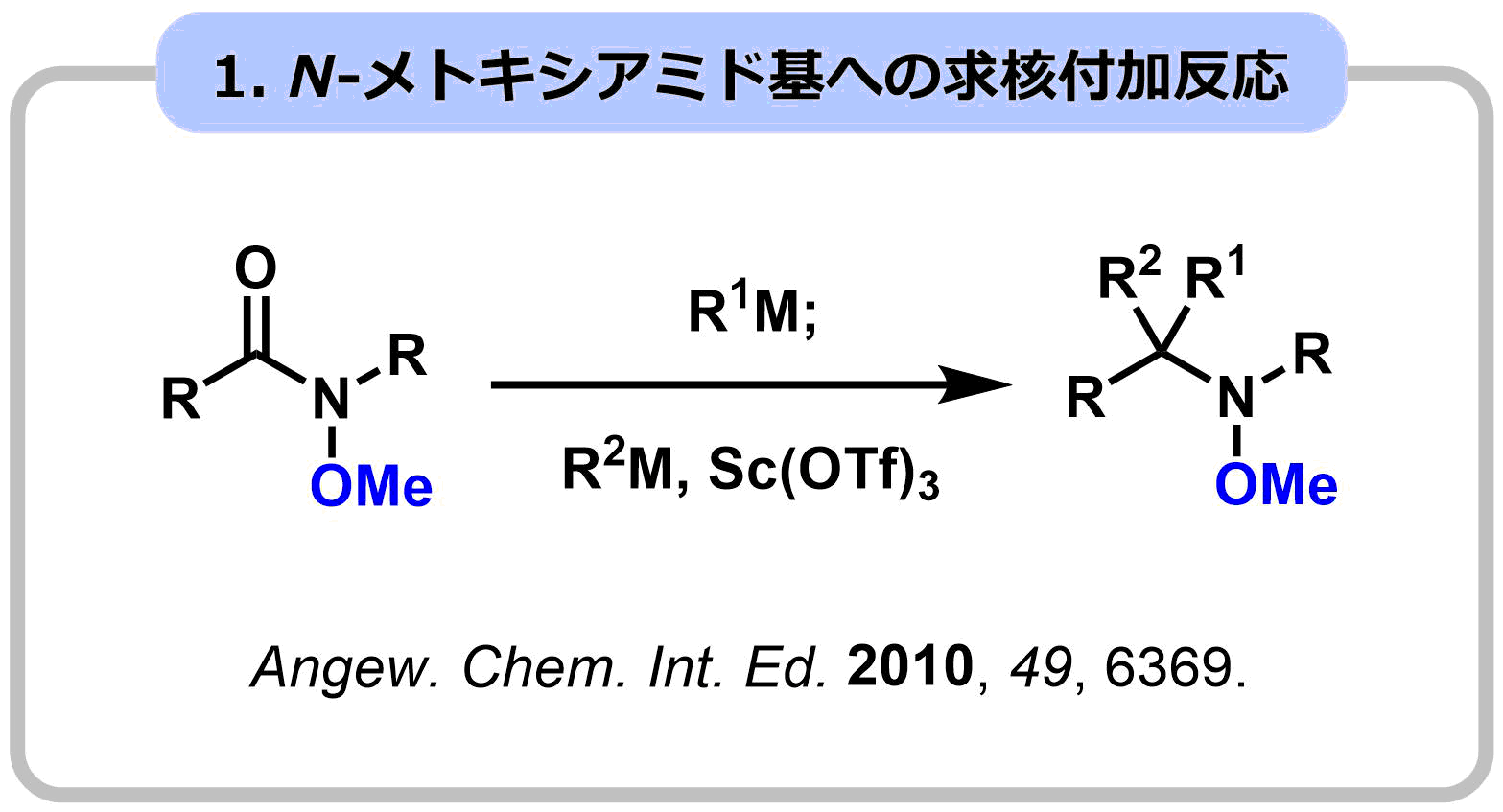
1-1. アルコキシ基でアミド基の反応性を制御する
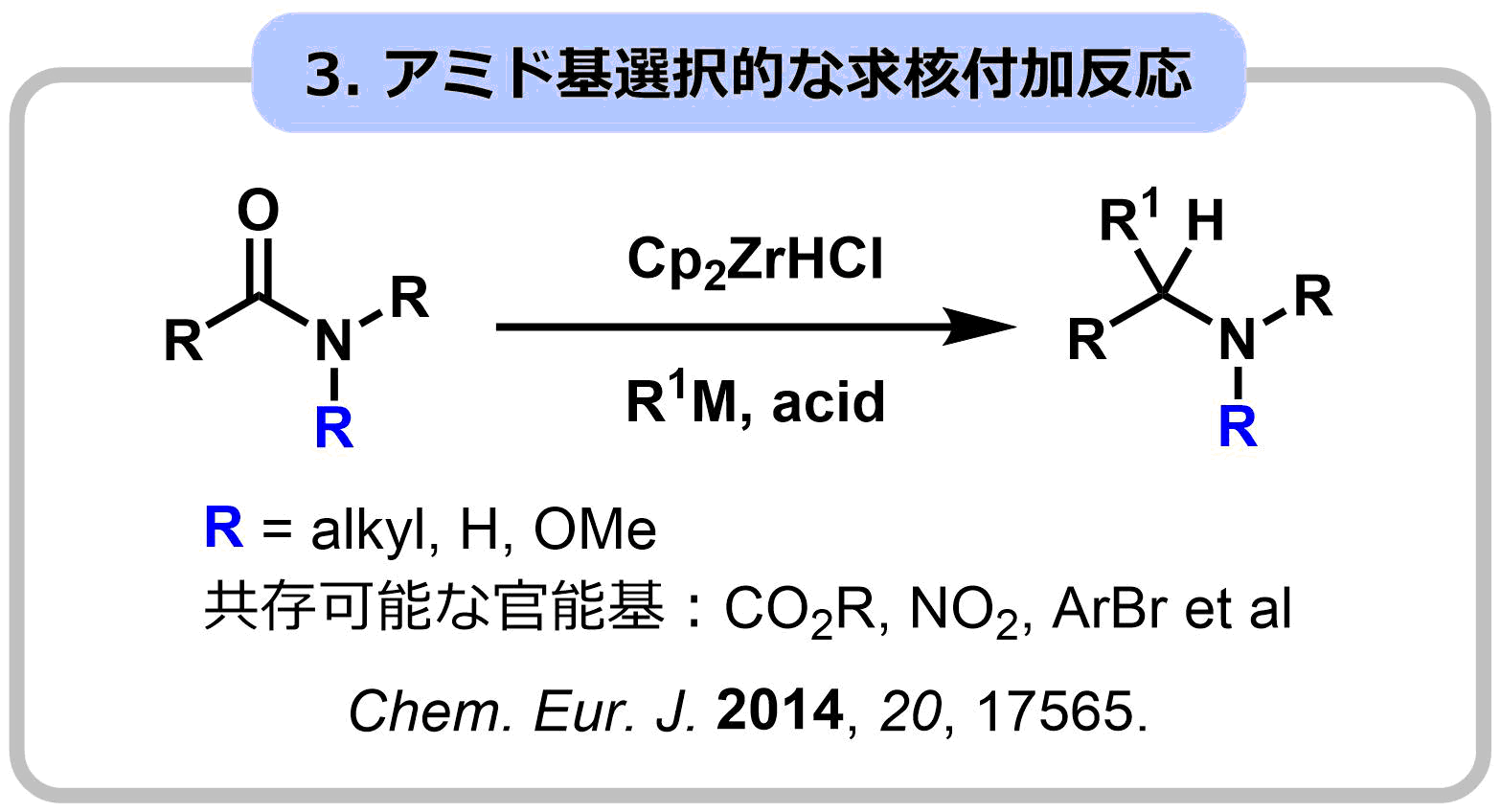
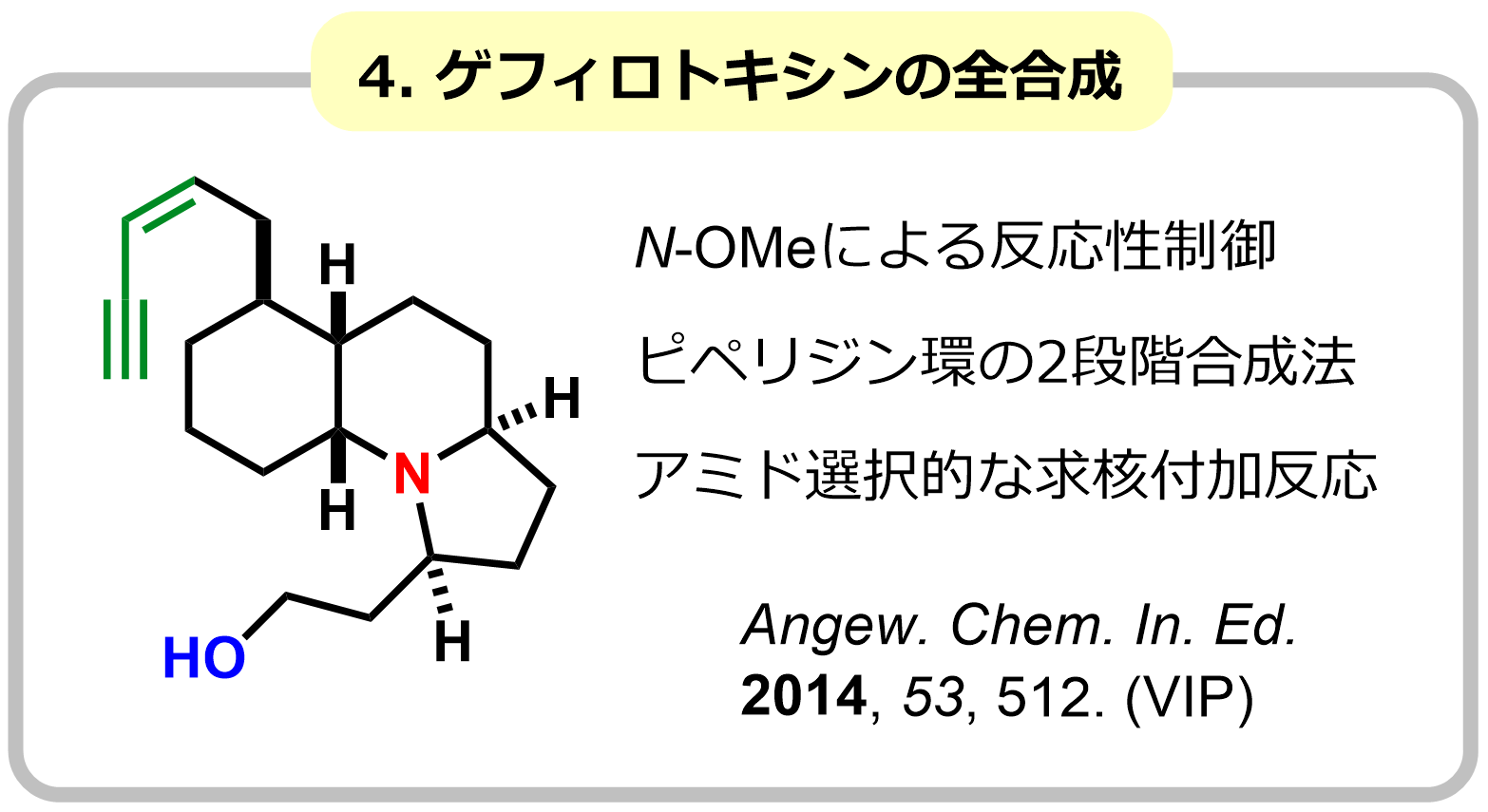
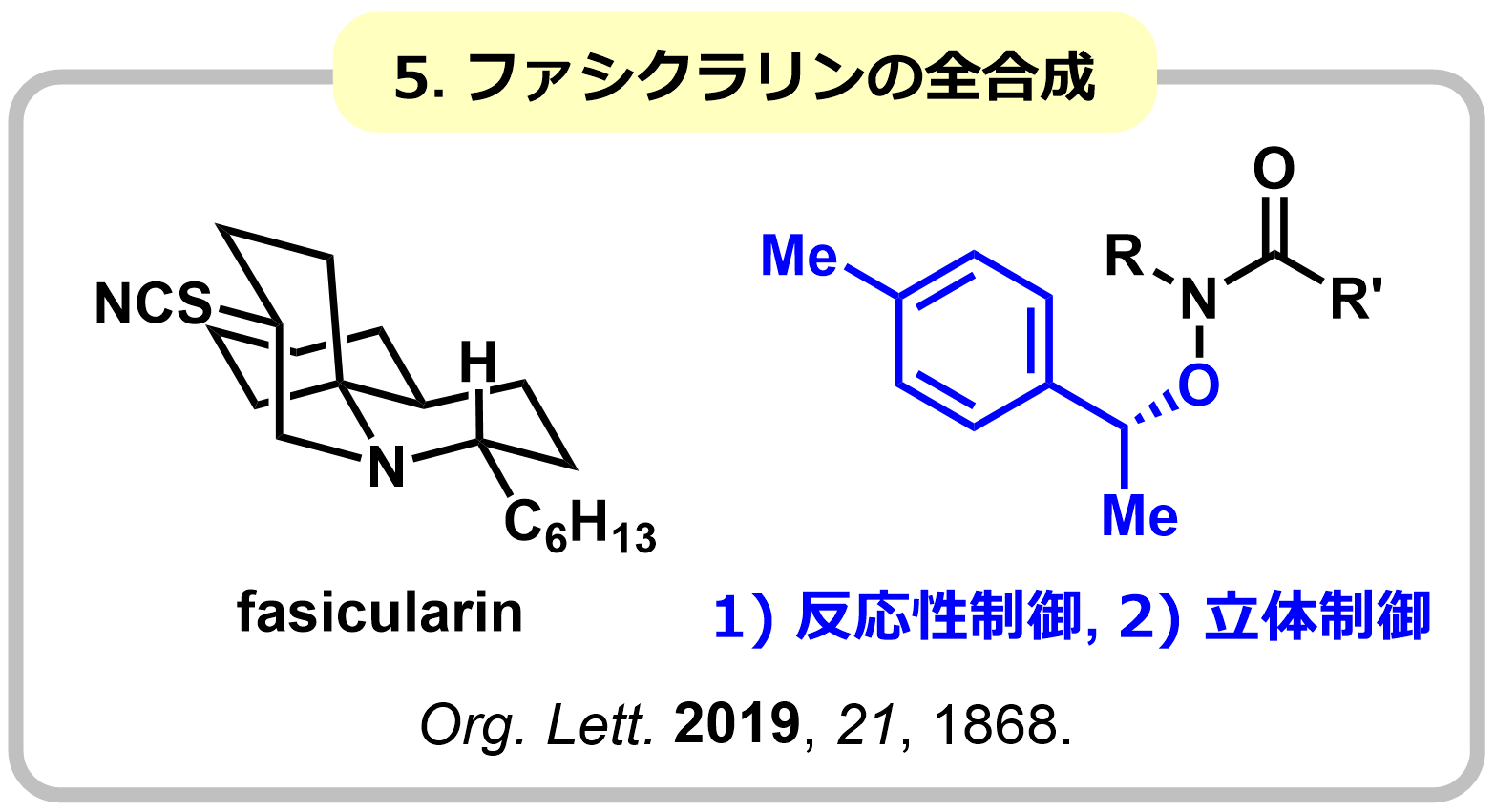
アミド基の窒素にアルコキシ基が導入されたN-アルコキシアミドは、特有の反応性を示します。この反応性制御効果を利用し、通常のアミドでは不可能な求核付加反応やアミド-アルデヒドカップリング反応を開発しました。さらに、Zr試薬の特性を利用し、エステルなどの求電子性が高い官能基が存在していても、アミド選択的に作用する求核付加反応の開発に成功し、ヤドクガエルの毒成分ゲフィロトキシンや、ファシクラリンの効率的全合成を実現しました。
|
|
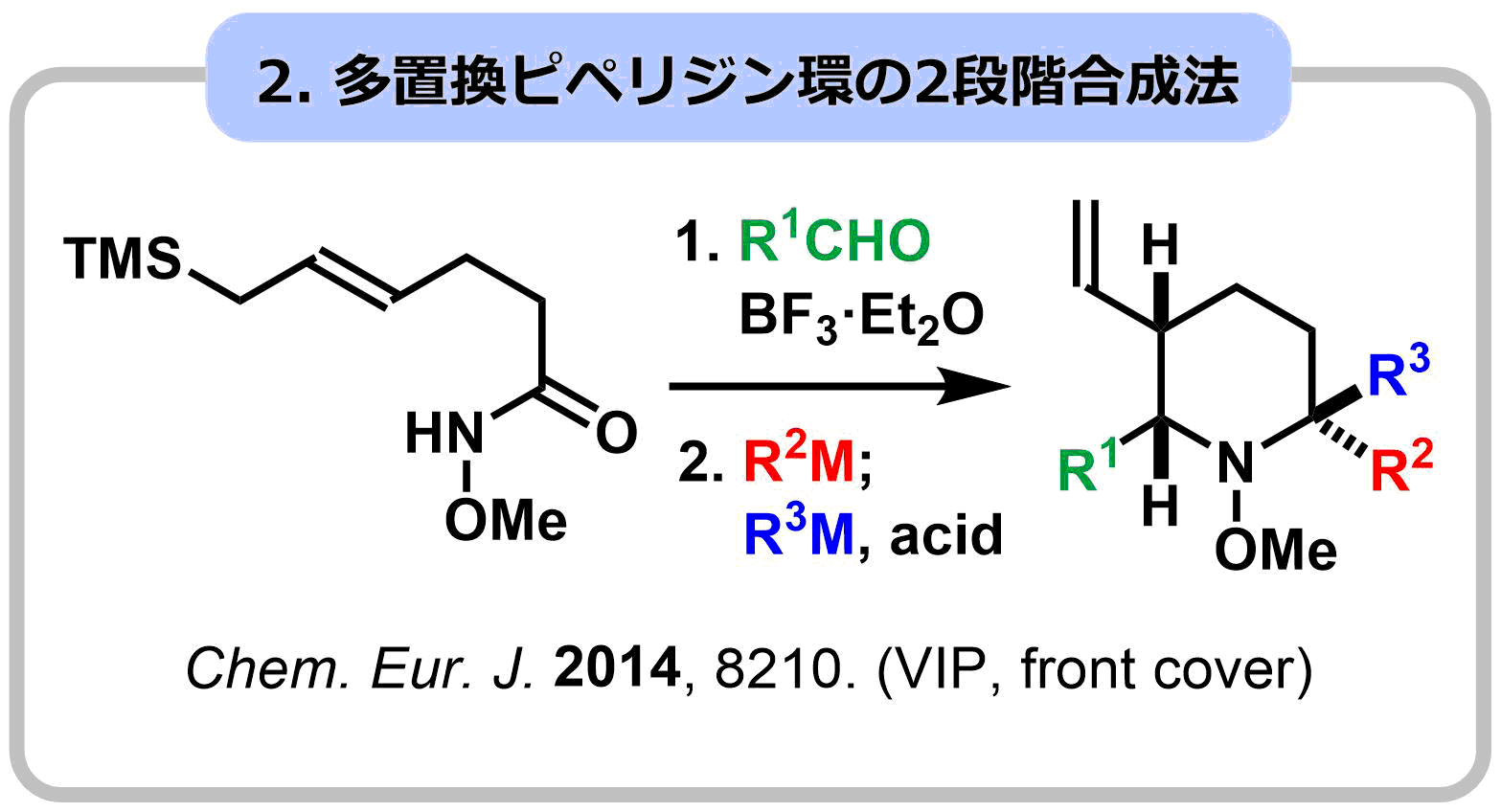
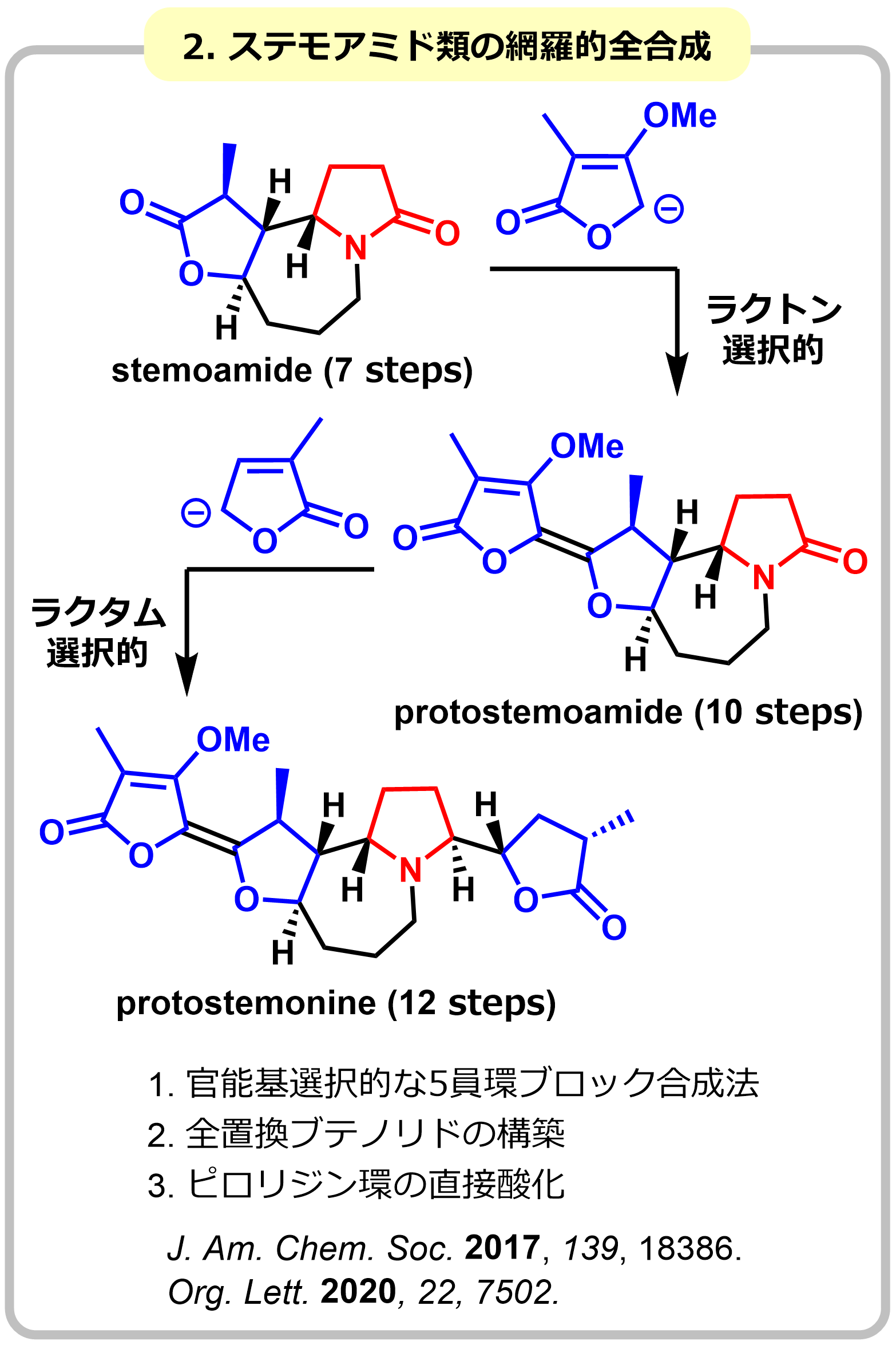
1-2. 官能基選択な5員環ブロック連結反応によるステモアミド類の網羅的全合成
一次代謝産物であるペプチドは、その構造多様性にもかかわらず、合成そのものは単量体であるアミノ酸の単純な縮合反応の繰り返しによって効率化されています。一方、多環性の二次代謝産物は、標的タンパク質などを多点認識できるため有用な生物活性が期待されていますが、複雑な構造のため合成ルートの開発が困難であり、創薬研究が立ち遅れています。
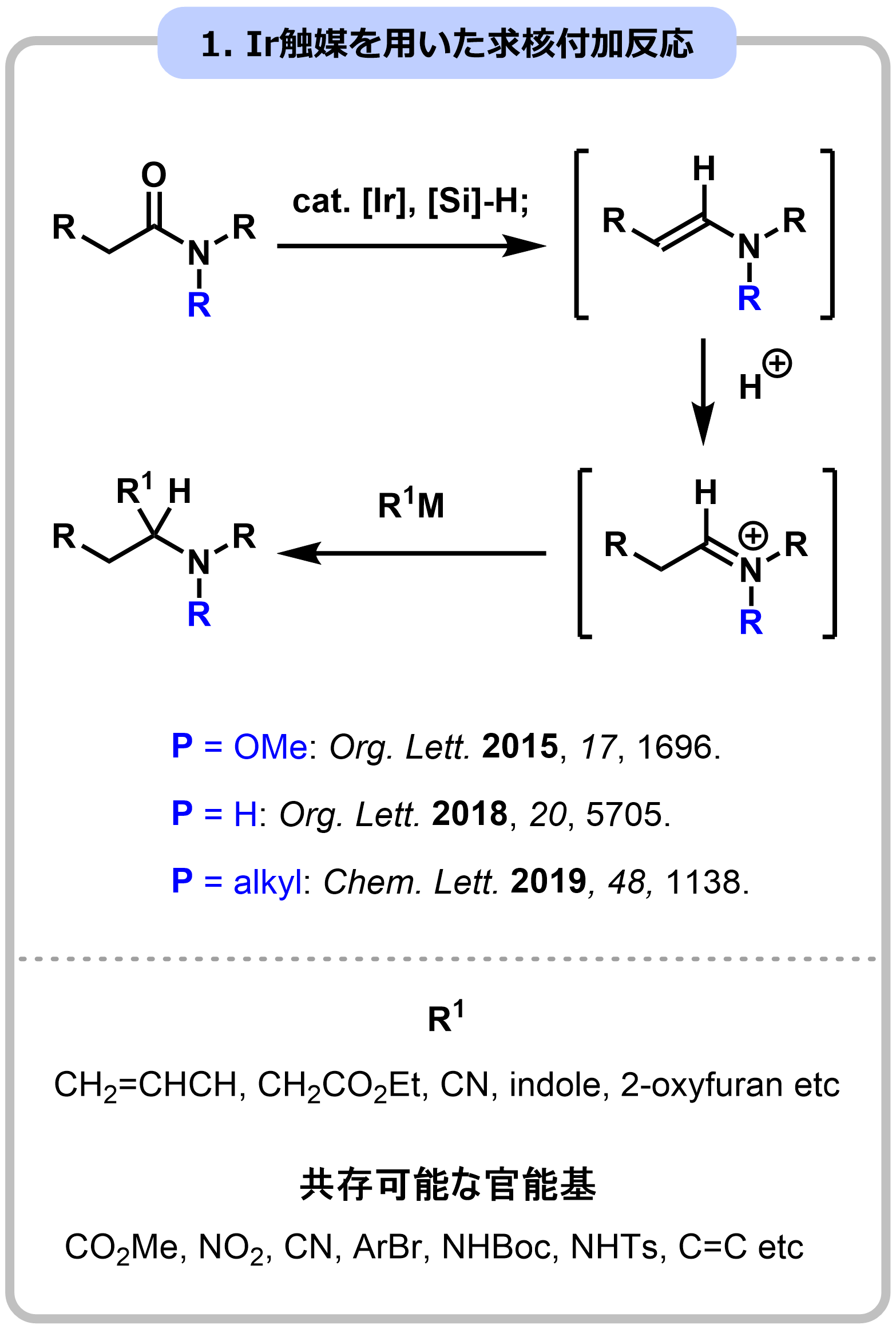
本研究では、一次代謝産物の反復合成法を模倣し、多環性の二次代謝産物であるステモアミド類の全合成の超短工程化に成功しました。単量体として5員環ブロックを設定し、求核付加反応によるブロック連結反応を繰り返して合成しました。この際、分子内に存在する各5員環ブロックの区別化(官能基選択性:ラクトンvsラクタム)が最大の課題となり、独自に開発に成功したIr触媒によるアミド選択的な求核付加反応が成功の鍵になりました。
|
1-3. アミド基を1,3-双極子等価体として利用する
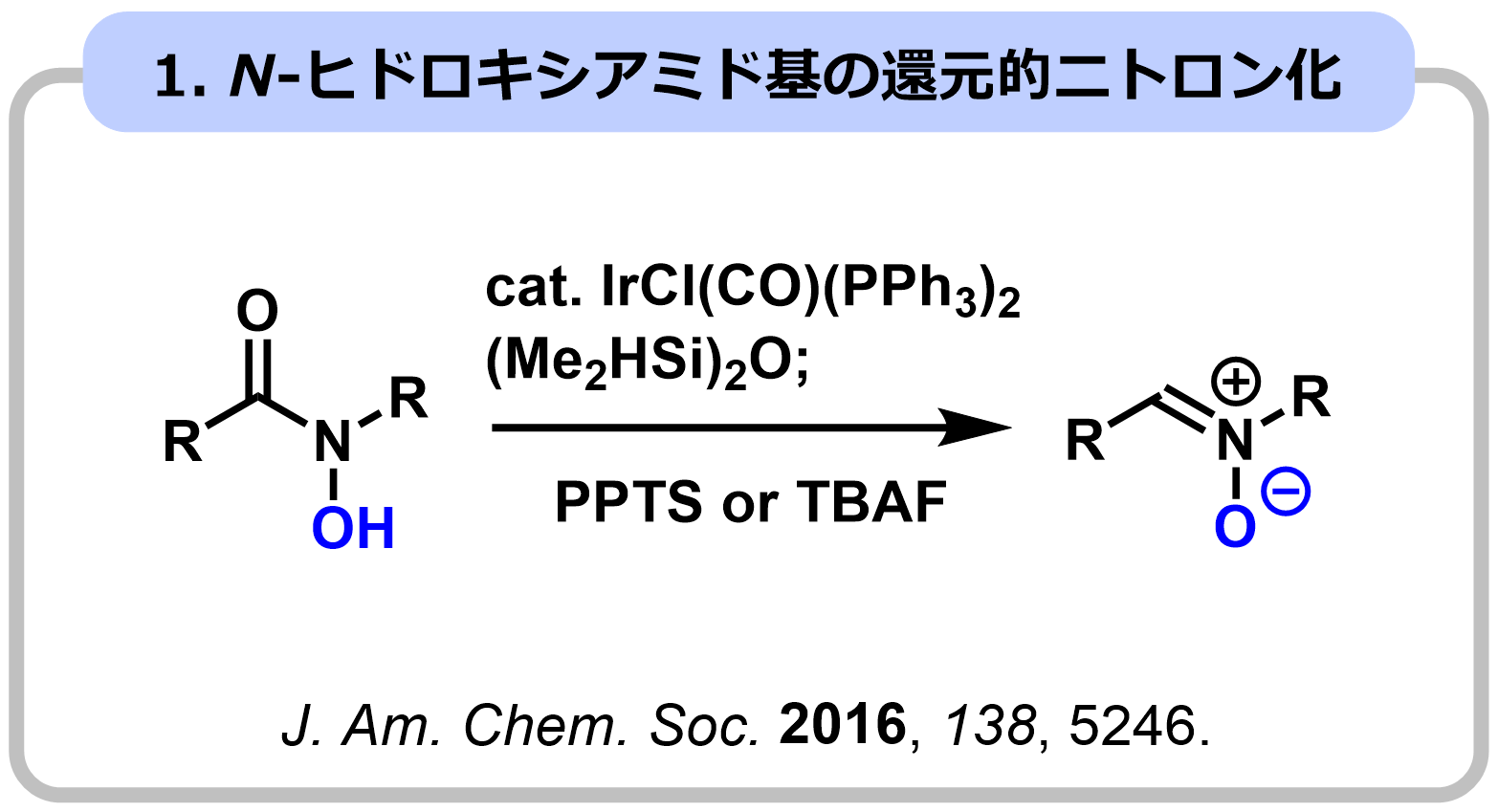
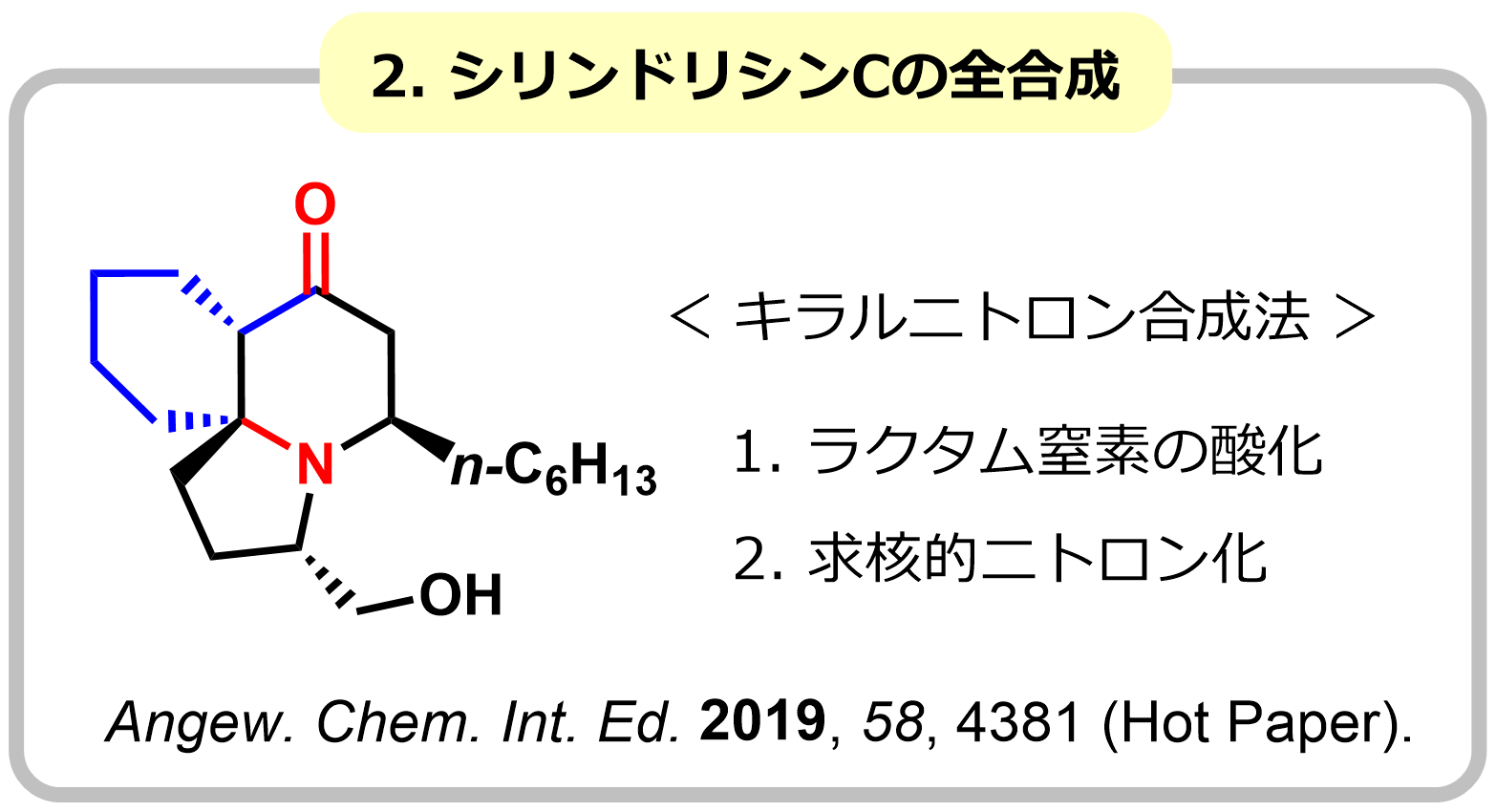
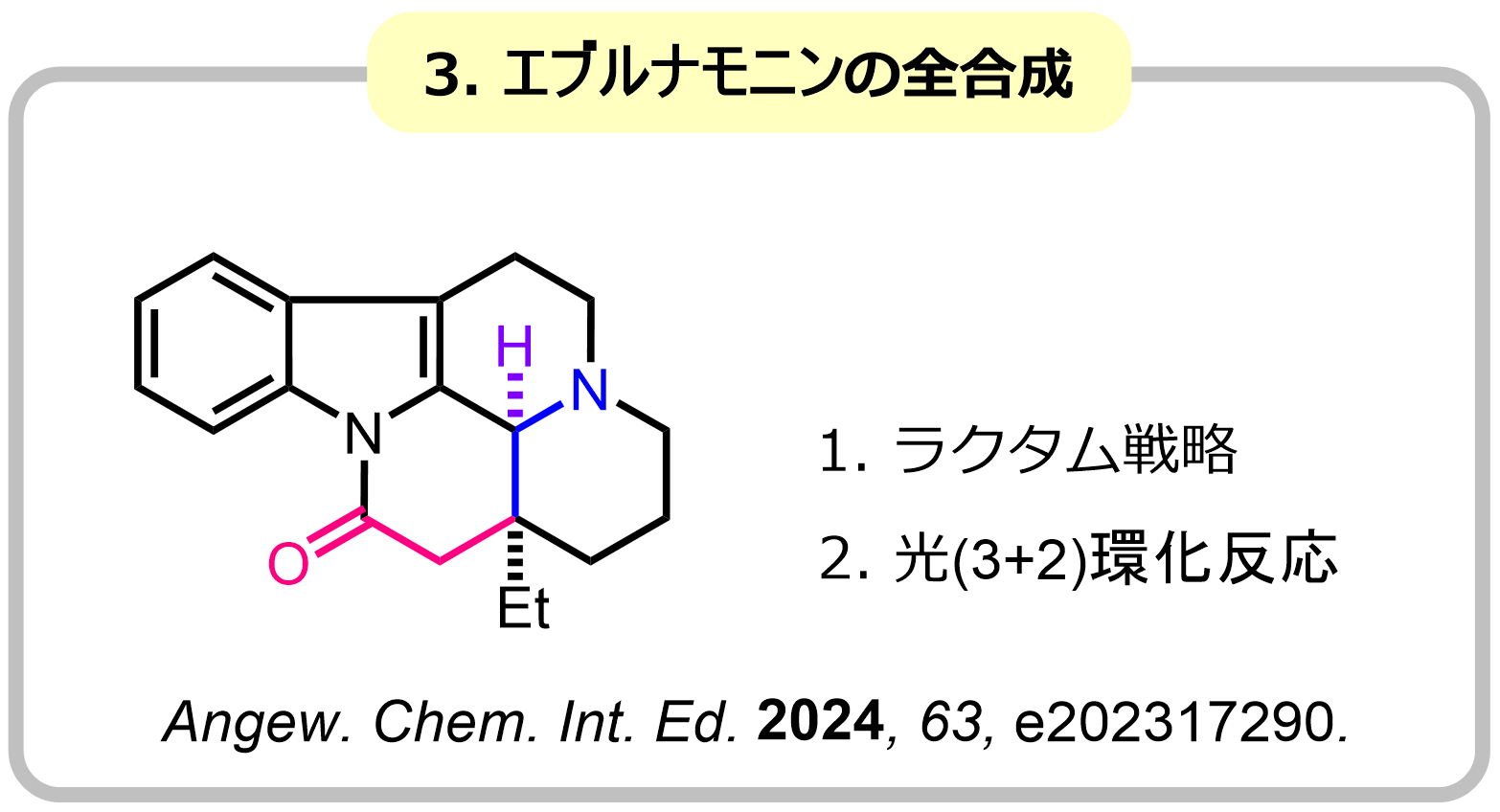
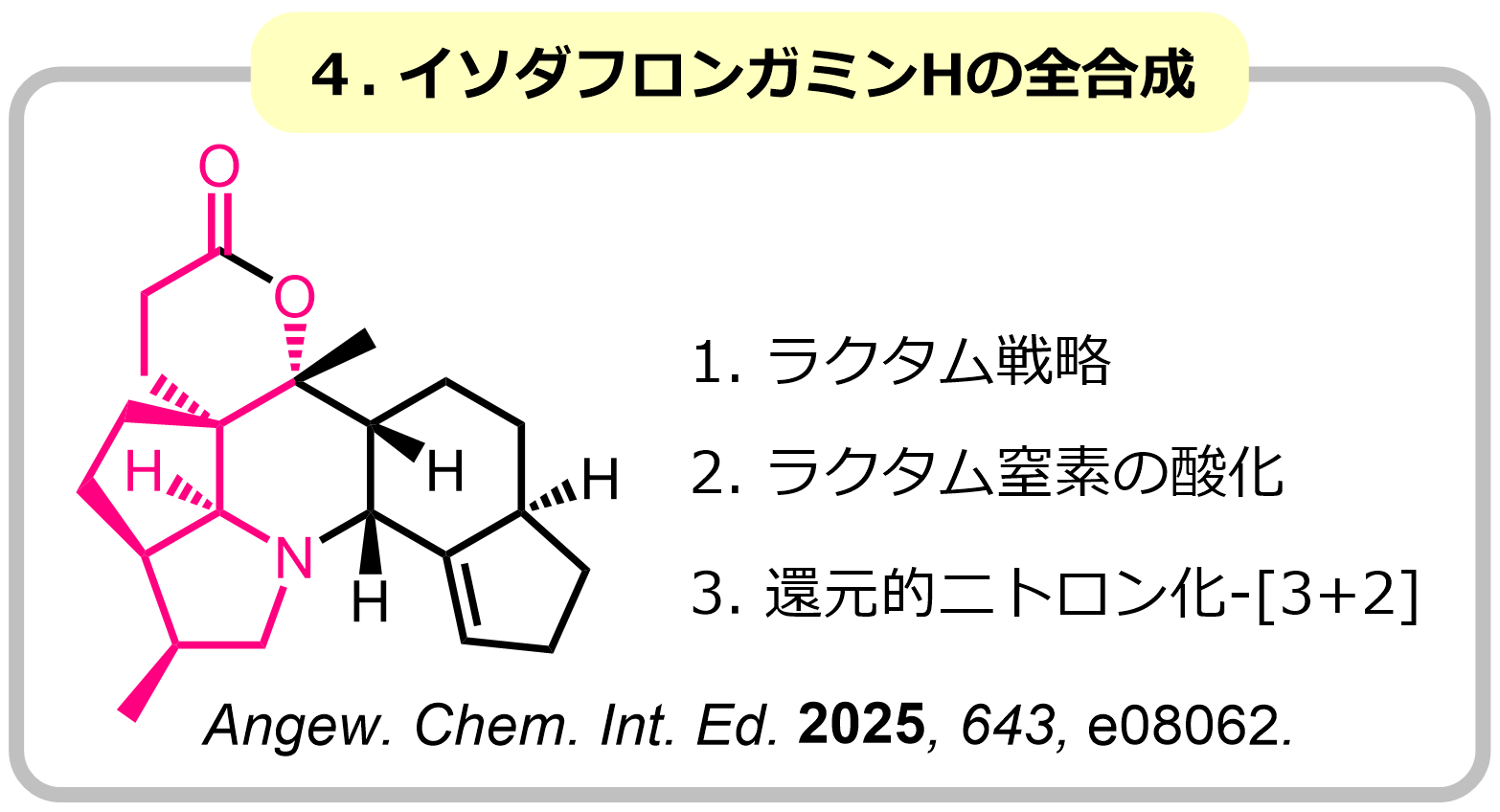
ニトロンは、[3+2]環化付加反応など様々な分子変換に利用できる官能基であり、生物活性化合物の合成中間体として広く利用されています。よく用いられるニトロン合成法としては、N-ヒドロキシアミンとカルボニル基の縮合反応や二級アミンの酸化反応が知られていますが、これらの方法は環状ニトロンの精密合成が困難など課題も多く、新たなニトロン合成法の開発が強く望まれています。私たちは、アミド基をニトロンやアゾメチンイリド等価体として[3+2]環化付加反応に利用する手法の開発に世界に先駆けて開発し、シリンドリシンC、エブルナモニン、イソダフロンガミンHの全合成に成功しました。
|
|
研究例2. アレン変換反応の開発と天然物合成への応用
アレンは、2つの2重結合が90度で直結した官能基で、SP軌道を含む独自の反応性から複雑分子の優れた合成中間体として期待されています。しかし、2つの2重結合に関連した選択性制御が困難なため、合成的利用が限られている官能基でもあります。私たちは、ホウ素上の置換基の大きさを変え、同一のアレンから立体発散的にアリルアルコールを合成できるヒドロホウ素化-酸化反応を開発しました。本反応は、生物活性天然物に広く見られるスキップジエン構造やアリルアリール構造の立体選択的な合成に応用でき、抗腫瘍活性を示すマダンガミン類やロバタミド類の網羅的全合成に成功しました。
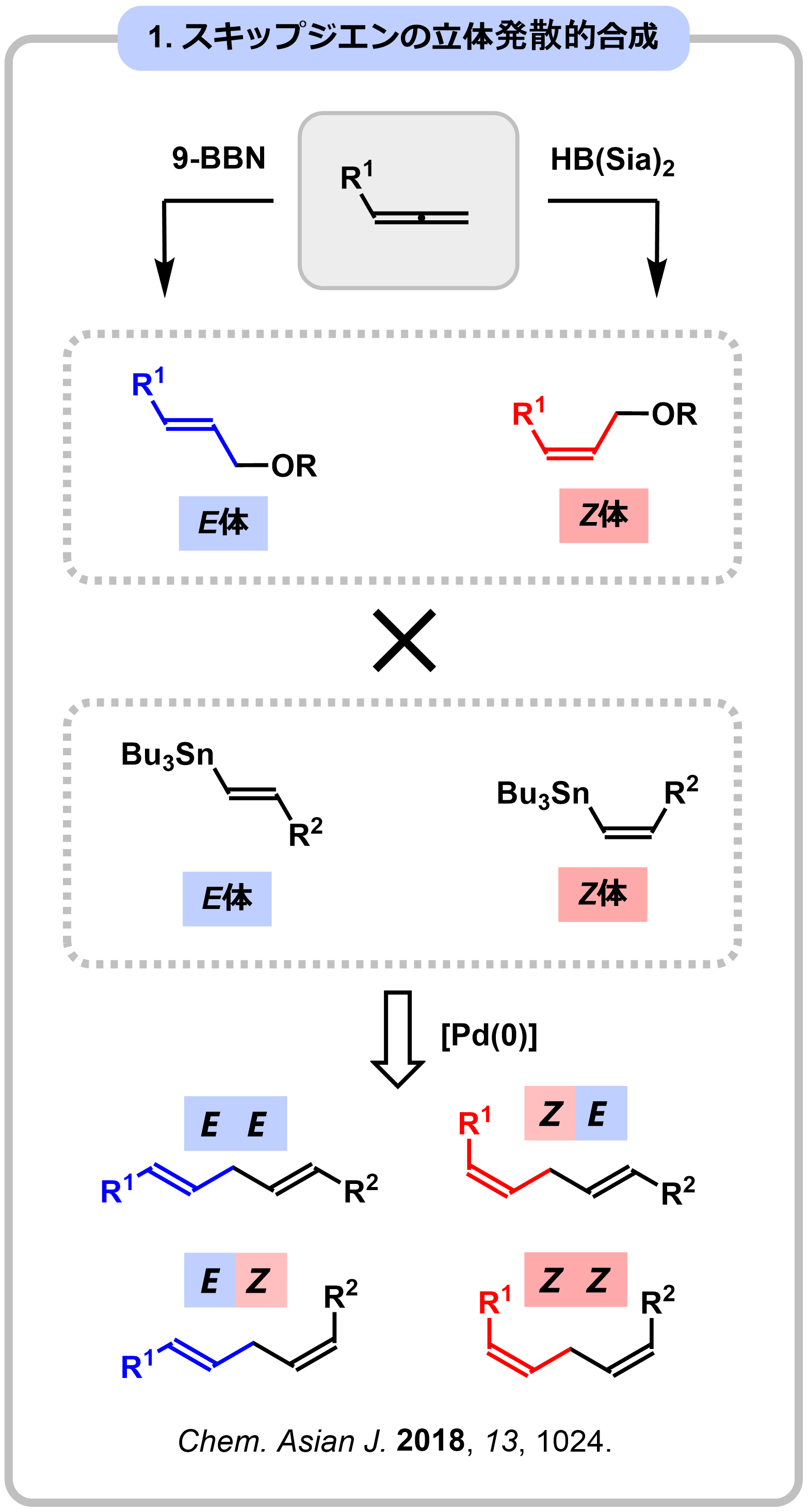
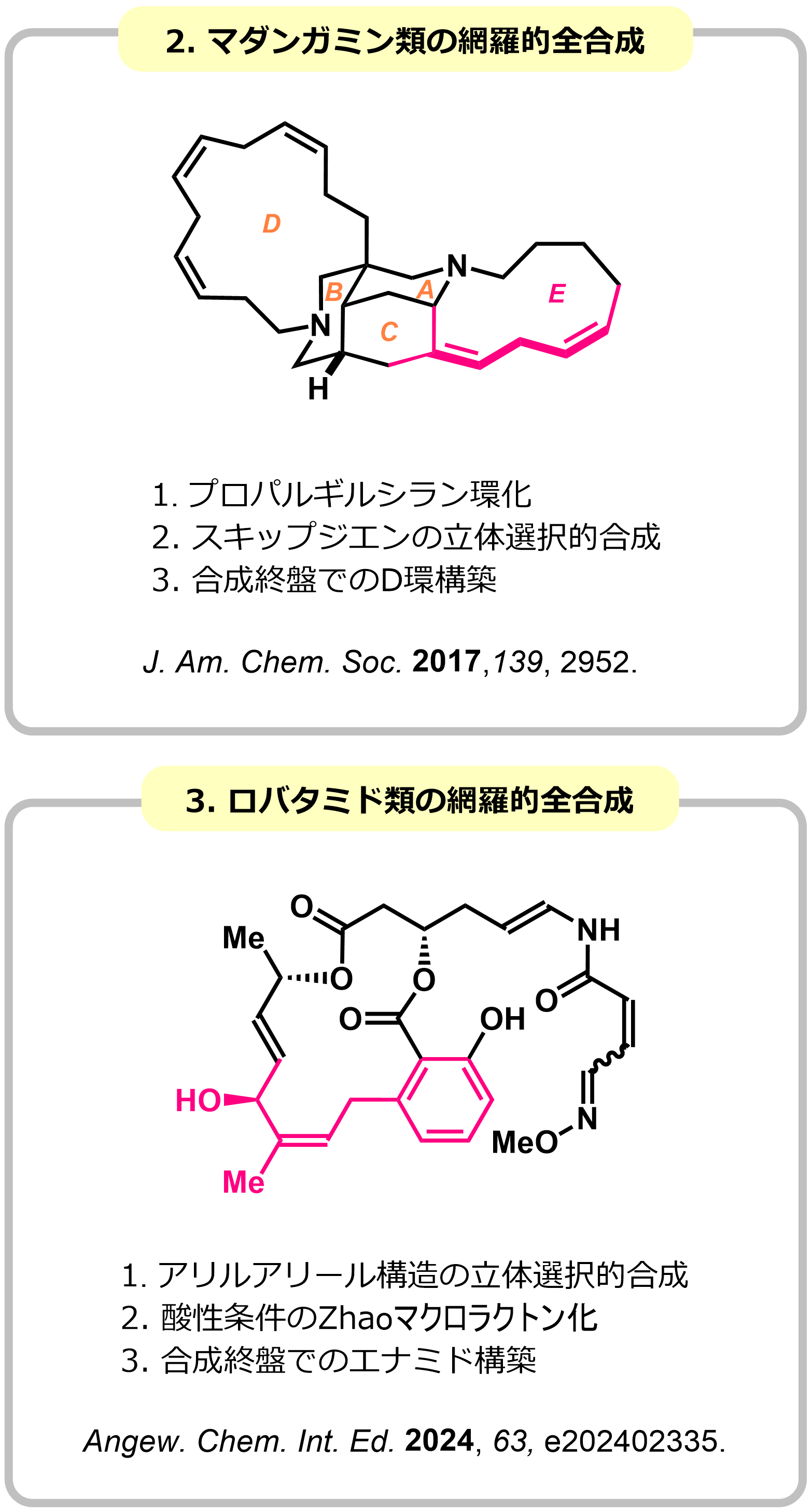
|
研究例3. 溶液反応と結晶化の共同作用による新たな選択性制御
複雑な天然物の合成では、速度論支配や熱力学的支配(遷移状態や生成物の安定性制御)を用いても、望む選択性が得られないことがしばしば起こります。私たちは、溶液での反応に結晶化プロセスを組み込み、溶液中では実現できない選択性制御法の開発に取り組んでいます。例として、動的結晶化を用いた位置選択的なDiels-Alder反応を開発し、ケラマフィジンBとインゲナミンの全合成を達成しました。位置選択性の制御が困難であったDiels-Alder反応において、平衡反応が進むにつれ、最も結晶性の高い生成物のみが析出してくる設計になっています。
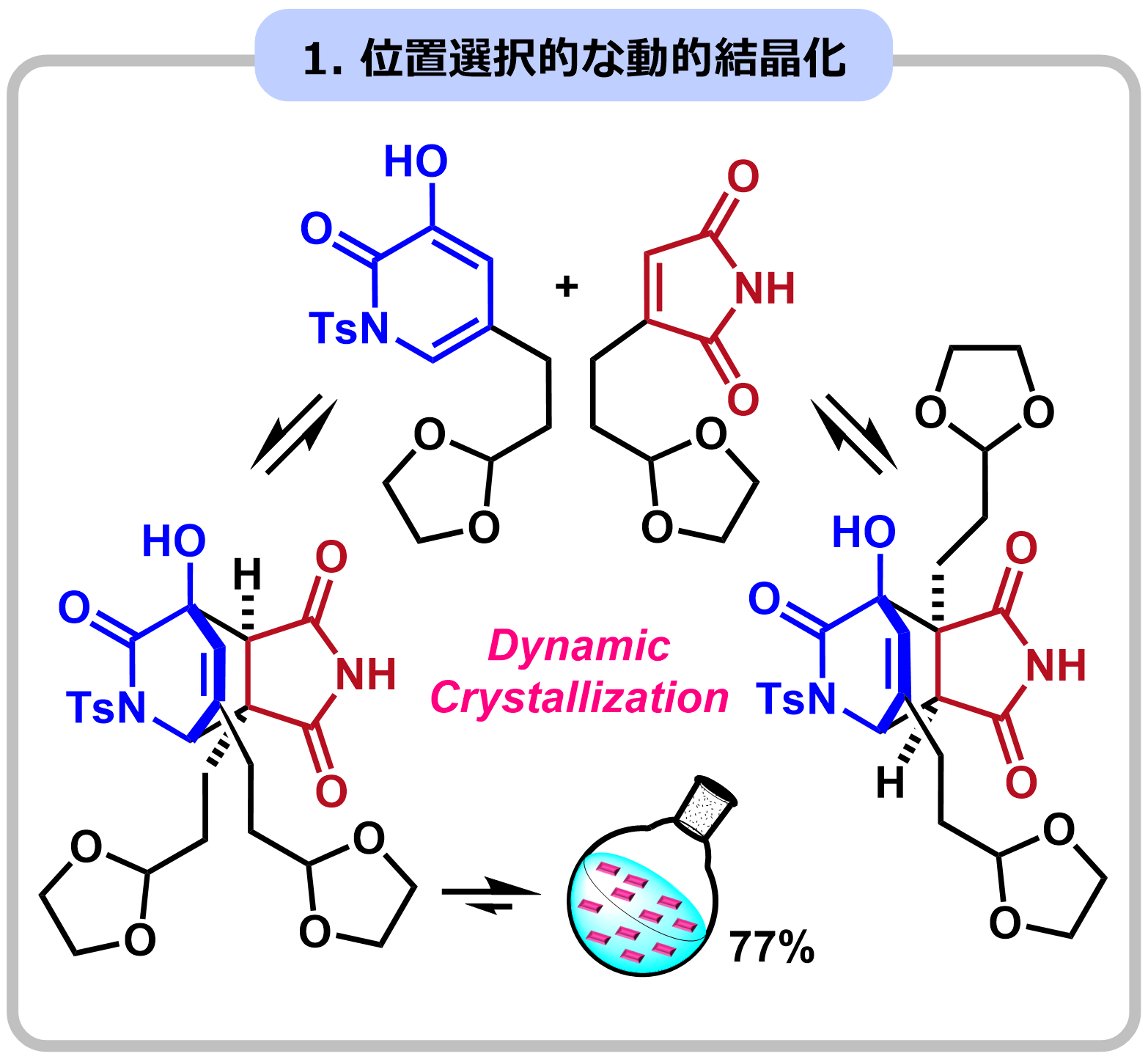
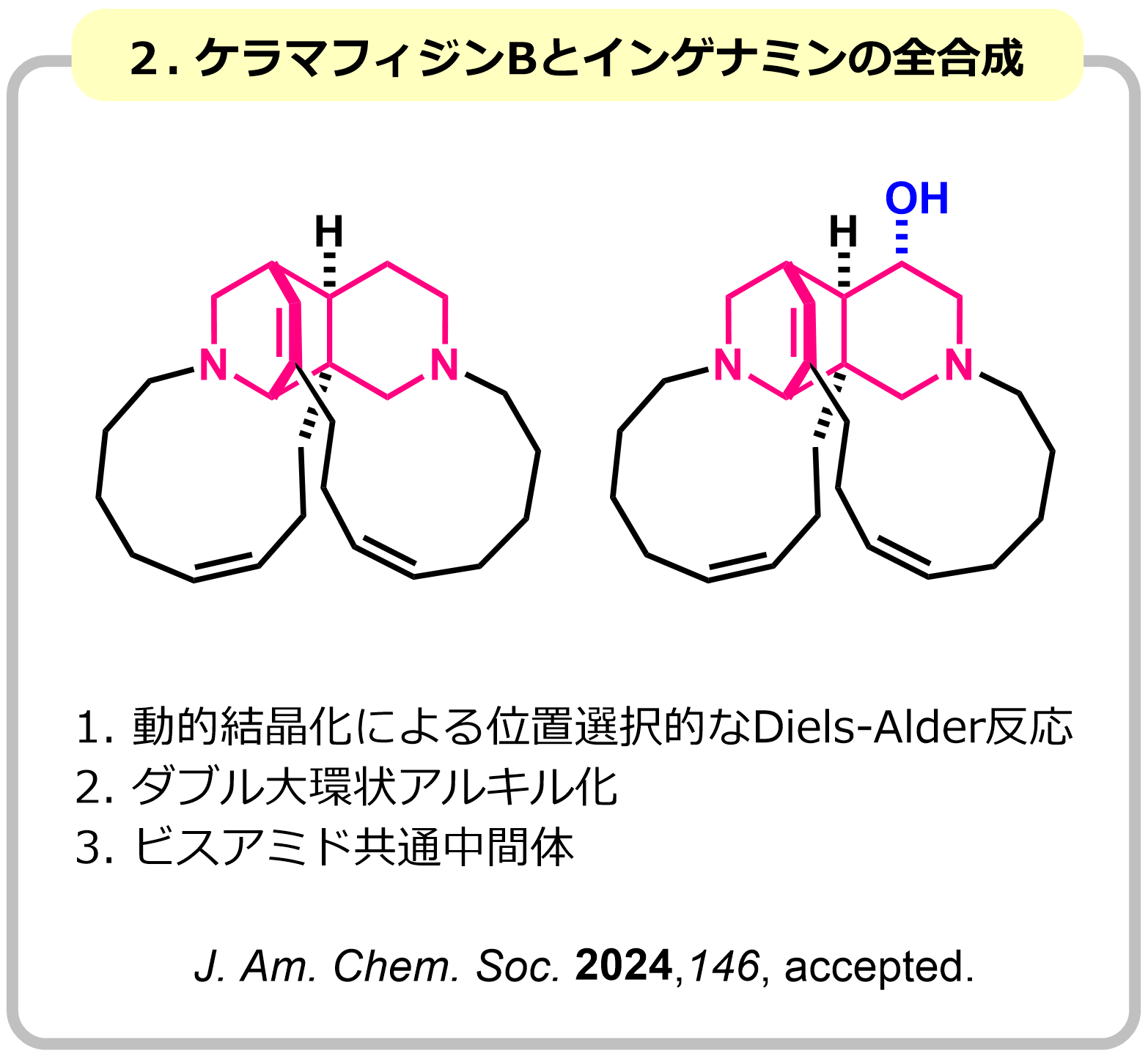
|
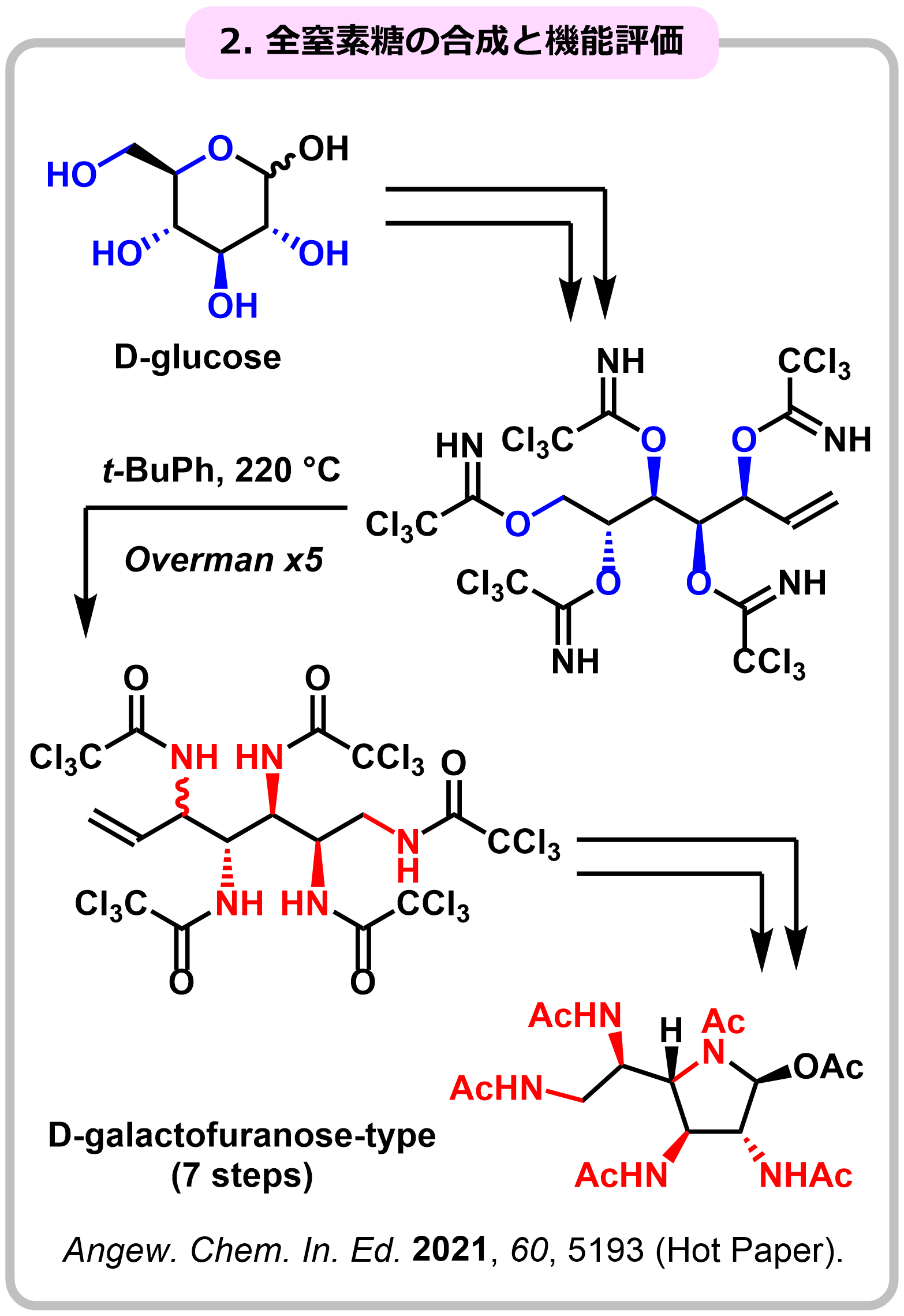
研究例4. 全窒素糖の合成と機能評価
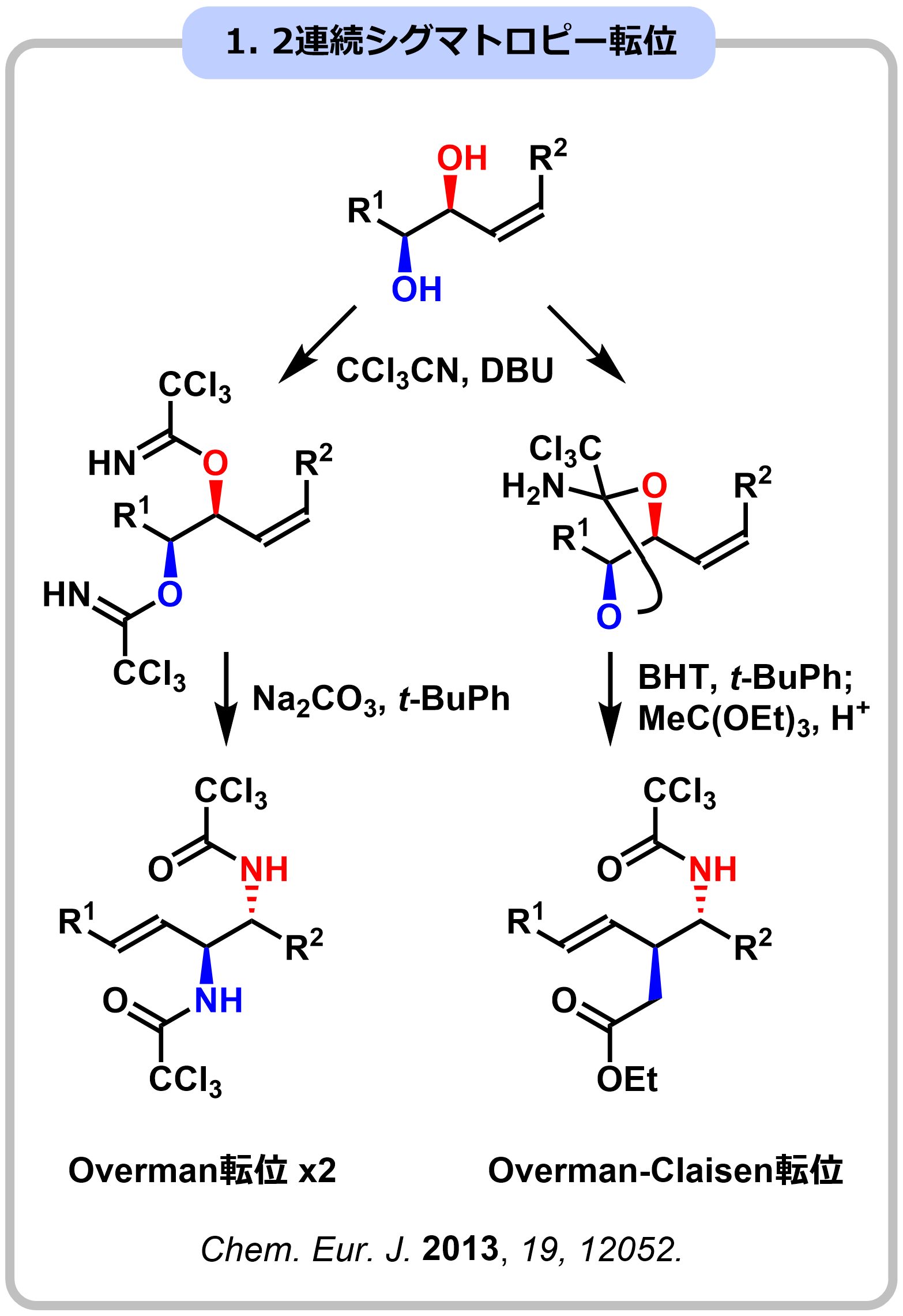
アミノグリコシド系抗生物質などに見られるように、糖の水酸基の一部が窒素で置換されたアミノ糖やイミノ糖は、生物活性の発現に重要な役割を果たしています。しかし、多剤耐性菌の出現などの課題が明らかになっており、新たな窒素糖骨格の開発が求められています。私達は、独自に開発した4連続・5連続Overman転位を基盤に、糖の全ての水酸基が窒素原子で置換された”全窒素糖”をデザインし、世界初の合成に成功しました。さらに合成した全窒素糖の誘導化、機能評価に取り組んでいます。
|