天 然 有 機 化 合 物 の 全 合 成 研 究
最近達成した全合成ここでは、これまでに只野研究室で行われてきた合成研究のうち、最近達成した全合成についていくつかご紹介します。
スピキュロ酸Aの全合成
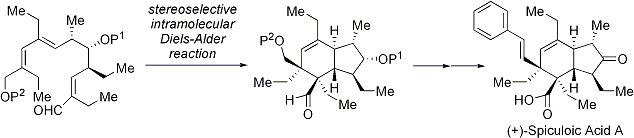
スピキュロ酸Aは2連続不斉四級炭素原子を含む6つの不斉中心を有し、ヒト腫瘍細胞に対する細胞増殖抑制作用を示すポリケチド由来の天然物です。私達は立体選択的な分子内Diels-Alder反応を鍵として二環性骨格と2連続不斉四級中心を一挙に構築し、スピキュロ酸Aの全合成を達成しました。さらに、ジッゴムフィン酸の全合成にも成功しました。
ref.) 1) Matsumura, D.; Toda, T.; Hayamizu, T.; Sawamura, K.; Takao, K.; Tadano, K. Tetrahedron Lett. 2009, 50, 3356.
2) Matsumura, D.; Takarabe, T.; Toda, T.; Hayamizu, T.; Sawamura, K.; Takao, K.; Tadano, K. Tetrahedron 2011, 67, 6730.
スピキュロ酸Aは2連続不斉四級炭素原子を含む6つの不斉中心を有し、ヒト腫瘍細胞に対する細胞増殖抑制作用を示すポリケチド由来の天然物です。私達は立体選択的な分子内Diels-Alder反応を鍵として二環性骨格と2連続不斉四級中心を一挙に構築し、スピキュロ酸Aの全合成を達成しました。さらに、ジッゴムフィン酸の全合成にも成功しました。

ref.) 1) Matsumura, D.; Toda, T.; Hayamizu, T.; Sawamura, K.; Takao, K.; Tadano, K. Tetrahedron Lett. 2009, 50, 3356.
2) Matsumura, D.; Takarabe, T.; Toda, T.; Hayamizu, T.; Sawamura, K.; Takao, K.; Tadano, K. Tetrahedron 2011, 67, 6730.
ペスタロチオプシンAの全合成
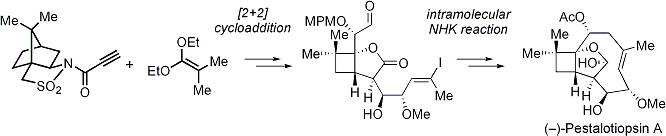
ペスタロチオプシンAは新規な三環性骨格を有するセスキテルペノイドです。免疫抑制作用や細胞毒性を有することが報告されています。私達は、光学活性なシクロブタン化合物の新しい合成法を開発し、さらに分子内NHK反応を利用して歪んだ九員環を構築することで(-)-ペスタロチオプシンAの全合成を達成しました。これにより、不明であった天然物の絶対構造を決定することができました。
ref.) 1) Takao, K.; Hayakawa, N.; Yamada, R.; Yamaguchi, T.; Morita, U.; Kawasaki, S.; Tadano, K. Angew. Chem. Int. Ed. 2008, 47, 3426.
2) Takao, K.; Hayakawa, N.; Yamada, R.; Yamaguchi, T.; Saegusa, H.; Uchida, M.; Samejima, S.; Tadano, K. J. Org. Chem. 2009, 74, 6452.
ペスタロチオプシンAは新規な三環性骨格を有するセスキテルペノイドです。免疫抑制作用や細胞毒性を有することが報告されています。私達は、光学活性なシクロブタン化合物の新しい合成法を開発し、さらに分子内NHK反応を利用して歪んだ九員環を構築することで(-)-ペスタロチオプシンAの全合成を達成しました。これにより、不明であった天然物の絶対構造を決定することができました。

ref.) 1) Takao, K.; Hayakawa, N.; Yamada, R.; Yamaguchi, T.; Morita, U.; Kawasaki, S.; Tadano, K. Angew. Chem. Int. Ed. 2008, 47, 3426.
2) Takao, K.; Hayakawa, N.; Yamada, R.; Yamaguchi, T.; Saegusa, H.; Uchida, M.; Samejima, S.; Tadano, K. J. Org. Chem. 2009, 74, 6452.
ツベラクトマイシン類の全合成
ツベラクトマイシン類は2000年に単離された新規マクロリド類抗生物質です。現在臨床に用いられている薬剤に対する耐性菌に、新規メカニズムによる強い抗菌活性を示すことが報告されています。
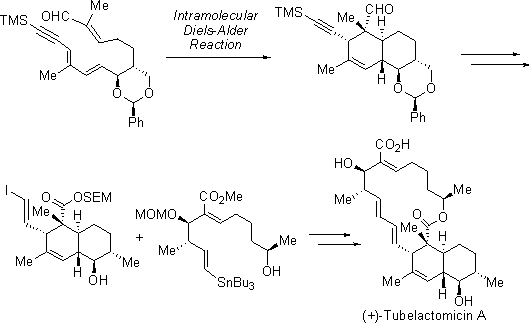
私達は、2つのセグメントを高収率にて合成し、それらを連結することでツベラクトマイシンAの初の全合成を達成しました。鍵となる分子内Diels-Alder反応は高立体選択的に進行し、その有効性を示すことができました。この効率的な合成法を用いて、ツベラクトマイシンB、D、およびEの合成にも成功しています。さらに、渡環Diels-Alder反応を用いた新規な合成法も開発しました。
ref.) 1) Motozaki, T.; Sawamura, K.; Suzuki, A.; Yoshida, K.; Ueki, T.; Ohara, A.; Munakata, R.; Takao, K.; Tadano, K. Org. Lett. 2005, 7, 2261 and 2265.
2) Sawamura, K.; Yoshida, K.; Suzuki, A.; Motozaki, T.; Kozawa, I.; Hayamizu, T.; Munakata, R.; Takao, K.; Tadano, K. J. Org. Chem. 2007, 72, 6143.
3) Anzo, T.; Suzuki, A.; Sawamura, K.; Motozaki, T.; Hatta, M.; Takao, K.; Tadano, K. Tetrahedron Lett. 2007, 48, 8442.
ツベラクトマイシン類は2000年に単離された新規マクロリド類抗生物質です。現在臨床に用いられている薬剤に対する耐性菌に、新規メカニズムによる強い抗菌活性を示すことが報告されています。
私達は、2つのセグメントを高収率にて合成し、それらを連結することでツベラクトマイシンAの初の全合成を達成しました。鍵となる分子内Diels-Alder反応は高立体選択的に進行し、その有効性を示すことができました。この効率的な合成法を用いて、ツベラクトマイシンB、D、およびEの合成にも成功しています。さらに、渡環Diels-Alder反応を用いた新規な合成法も開発しました。

ref.) 1) Motozaki, T.; Sawamura, K.; Suzuki, A.; Yoshida, K.; Ueki, T.; Ohara, A.; Munakata, R.; Takao, K.; Tadano, K. Org. Lett. 2005, 7, 2261 and 2265.
2) Sawamura, K.; Yoshida, K.; Suzuki, A.; Motozaki, T.; Kozawa, I.; Hayamizu, T.; Munakata, R.; Takao, K.; Tadano, K. J. Org. Chem. 2007, 72, 6143.
3) Anzo, T.; Suzuki, A.; Sawamura, K.; Motozaki, T.; Hatta, M.; Takao, K.; Tadano, K. Tetrahedron Lett. 2007, 48, 8442.
1893Aおよび1893Bの全合成
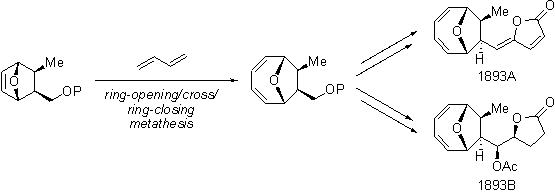
1893Aおよび1893Bはマイコエポキシジエンと同様に酸素原子で架橋されたシクロオクタジエン骨格を有する天然有機化合物です。私達は、マイコエポキシジエンの全合成において開発した合成法、すなわち開環/交差/閉環メタセシス反応を用いて、これら化合物の全合成を達成しました。この全合成によって、不明であった1893Bの立体化学を決定することができました。さらに、合成したサンプルの生物活性の評価も行い、これら化合物の生物学的性質も明らかにすることができました。
ref.) 1) Takao, K.; Yasui, H.; Yamamoto, S.; Sasaki, D.; Kawasaki, S.; Watanabe, G.; Tadano, K. J. Org. Chem. 2004, 69, 8789. 2) Yasui, H.; Hirai, K.; Yamamoto, S.; Takao, K.; Tadano, K. Heterocycles 2006, 67, 123.
3) Yasui, H.; Hirai, K.; Yamamoto, S.; Takao, K.; Tadano, K. J. Antibiot. 2006, 59, 456.
1893Aおよび1893Bはマイコエポキシジエンと同様に酸素原子で架橋されたシクロオクタジエン骨格を有する天然有機化合物です。私達は、マイコエポキシジエンの全合成において開発した合成法、すなわち開環/交差/閉環メタセシス反応を用いて、これら化合物の全合成を達成しました。この全合成によって、不明であった1893Bの立体化学を決定することができました。さらに、合成したサンプルの生物活性の評価も行い、これら化合物の生物学的性質も明らかにすることができました。

ref.) 1) Takao, K.; Yasui, H.; Yamamoto, S.; Sasaki, D.; Kawasaki, S.; Watanabe, G.; Tadano, K. J. Org. Chem. 2004, 69, 8789. 2) Yasui, H.; Hirai, K.; Yamamoto, S.; Takao, K.; Tadano, K. Heterocycles 2006, 67, 123.
3) Yasui, H.; Hirai, K.; Yamamoto, S.; Takao, K.; Tadano, K. J. Antibiot. 2006, 59, 456.
マクアリミシン類の全合成
マクアリミシン類は1995年に単離された新規抗生物質です。マクアリミシンAは経口投与にて抗炎症活性を、マクアリミシンBおよびCはP388白血病細胞に対し細胞毒性を示すことが報告されています。また、天然には今までにない特異な四/五環性骨格を有することが構造上の特徴です。
私達のグループでは生合成にヒントを得た渡環的Diels-Alder反応(TADA)を合成戦略に取り入れ、合成研究を行ってきました。そして、TADAにより四環性骨格を一挙に構築し、マクアリミシンAの最初の全合成を達成しました。本研究を通じて、複雑な多環性骨格の構築に対するTADAの有用性を示すことができました。さらには、マクアリミシンBおよびCの全合成にも成功しました。
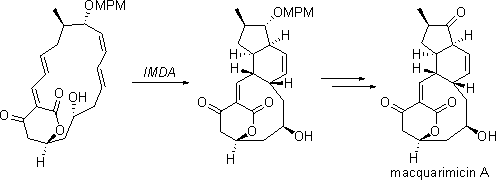
ref.) ref.) 1) Munakata, R.; Katakai, H.; Ueki, T.; Kurosaka, J.; Takao, K.; Tadano, K. J. Am. Chem. Soc. 2003, 125, 14722.
2) Munakata, R.; Katakai, H.; Ueki, T.; Kurosaka, J.; Takao, K.; Tadano, K. J. Am. Chem. Soc. 2004, 126, 11254.
マクアリミシン類は1995年に単離された新規抗生物質です。マクアリミシンAは経口投与にて抗炎症活性を、マクアリミシンBおよびCはP388白血病細胞に対し細胞毒性を示すことが報告されています。また、天然には今までにない特異な四/五環性骨格を有することが構造上の特徴です。
私達のグループでは生合成にヒントを得た渡環的Diels-Alder反応(TADA)を合成戦略に取り入れ、合成研究を行ってきました。そして、TADAにより四環性骨格を一挙に構築し、マクアリミシンAの最初の全合成を達成しました。本研究を通じて、複雑な多環性骨格の構築に対するTADAの有用性を示すことができました。さらには、マクアリミシンBおよびCの全合成にも成功しました。

ref.) ref.) 1) Munakata, R.; Katakai, H.; Ueki, T.; Kurosaka, J.; Takao, K.; Tadano, K. J. Am. Chem. Soc. 2003, 125, 14722.
2) Munakata, R.; Katakai, H.; Ueki, T.; Kurosaka, J.; Takao, K.; Tadano, K. J. Am. Chem. Soc. 2004, 126, 11254.
マイコエポキシジエンの全合成
マイコエポキシジエンは、1999年にカビの培養液から単離された化合物です。その構造は、酸素原子で架橋されたシクロオクタジエン骨格およびα,β-不飽和δ-ラクトンからなっており、今までに例のない特徴を有しています。私達は、酵素を用いた不斉非対称化および、連続オレフィンメタセシス反応を用い、マイコエポキシジエンの両エナンチオマーの不斉全合成を達成しました。
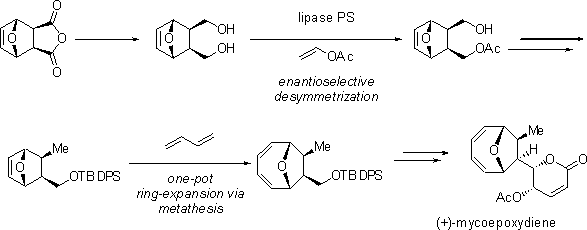
ref.) 1) Takao, K.; Watanabe, G.; Yasui, H.; Tadano, K. Org. Lett. 2002, 4, 2941.
2) Takao, K.; Yasui, H.; Yamamoto, S.; Sasaki, D.; Kawasaki, S.; Watanabe, G.; Tadano, K. J. Org. Chem. 2004, 69, 8789.
マイコエポキシジエンは、1999年にカビの培養液から単離された化合物です。その構造は、酸素原子で架橋されたシクロオクタジエン骨格およびα,β-不飽和δ-ラクトンからなっており、今までに例のない特徴を有しています。私達は、酵素を用いた不斉非対称化および、連続オレフィンメタセシス反応を用い、マイコエポキシジエンの両エナンチオマーの不斉全合成を達成しました。

ref.) 1) Takao, K.; Watanabe, G.; Yasui, H.; Tadano, K. Org. Lett. 2002, 4, 2941.
2) Takao, K.; Yasui, H.; Yamamoto, S.; Sasaki, D.; Kawasaki, S.; Watanabe, G.; Tadano, K. J. Org. Chem. 2004, 69, 8789.
シューロチンおよびアザスピレンの全合成
シューロチンAは、1976年に神経突起伸長促進活性を示す化合物として、アザスピレンは、2002年に血管新生阻害作用を示す化合物としてそれぞれ単離されました。これら化合物の構造上の特徴は、特異なスピロ構造を基本骨格とし、連続する3つの不斉炭素原子を含む点にあります。私達は、構造上だけでなく生物活性上も興味深いこれら天然物の全合成研究を行い、D-グルコースを出発物質とした全合成を達成しました。さらに、類似の構造を有する抗菌活性物質プラマニシンの全合成にも成功しました。
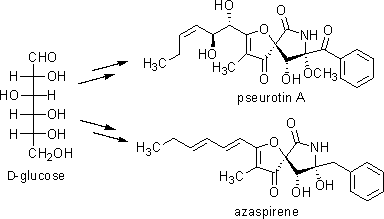
ref.) 1) Aoki, S.; Oi, T.; Shimizu, K.; Shiraki, R.; Takao, K.; Tadano, K. Heterocycles 2004, 62, 161.
2) Aoki, S.; Oi, T.; Shimizu, K.; Shiraki, R.; Takao, K.; Tadano, K. Bull. Chem. Soc. Jpn. 2004, 77, 1703.
3) Aoki, S.; Tsukude, T.; Miyazaki, Y.; Takao, K.; Tadano, K. Heterocycles 2006, 69, 49.
シューロチンAは、1976年に神経突起伸長促進活性を示す化合物として、アザスピレンは、2002年に血管新生阻害作用を示す化合物としてそれぞれ単離されました。これら化合物の構造上の特徴は、特異なスピロ構造を基本骨格とし、連続する3つの不斉炭素原子を含む点にあります。私達は、構造上だけでなく生物活性上も興味深いこれら天然物の全合成研究を行い、D-グルコースを出発物質とした全合成を達成しました。さらに、類似の構造を有する抗菌活性物質プラマニシンの全合成にも成功しました。

ref.) 1) Aoki, S.; Oi, T.; Shimizu, K.; Shiraki, R.; Takao, K.; Tadano, K. Heterocycles 2004, 62, 161.
2) Aoki, S.; Oi, T.; Shimizu, K.; Shiraki, R.; Takao, K.; Tadano, K. Bull. Chem. Soc. Jpn. 2004, 77, 1703.
3) Aoki, S.; Tsukude, T.; Miyazaki, Y.; Takao, K.; Tadano, K. Heterocycles 2006, 69, 49.
UPA0043 および 0044の全合成
UPA0043 および 0044 は大正製薬により単離された新規抗生物質であり、ヒト白血病細胞HL-60や真菌であるCandida albicans に対する細胞毒性を有しています。さらに、ドリマン型セスキテルペノイド部とシキミ酸由来の部分からなるハイブリッド型構造を有しており、その活性はp−キノンメチド部に由来するものと考えられます。当研究室では、大正製薬との共同研究を行い、その全合成を達成しました。
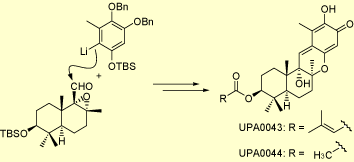
この合成研究においては、容易に入手可能なグリチルレチン酸を出発原料とし、上に示すカップリング反応を鍵反応とする収束的かつ効率的な合成ルートを開発することに成功しました。その結果、不明であった絶対立体化学も決定されました。
ref.) Takao, K.; Sasaki, T.; Kozaki, T.; Yanagisawa, Y.; Tadano, K.; Kawashima, A.; Shinonaga, H. Org. Lett. 2001, 3, 4291.
UPA0043 および 0044 は大正製薬により単離された新規抗生物質であり、ヒト白血病細胞HL-60や真菌であるCandida albicans に対する細胞毒性を有しています。さらに、ドリマン型セスキテルペノイド部とシキミ酸由来の部分からなるハイブリッド型構造を有しており、その活性はp−キノンメチド部に由来するものと考えられます。当研究室では、大正製薬との共同研究を行い、その全合成を達成しました。

この合成研究においては、容易に入手可能なグリチルレチン酸を出発原料とし、上に示すカップリング反応を鍵反応とする収束的かつ効率的な合成ルートを開発することに成功しました。その結果、不明であった絶対立体化学も決定されました。
ref.) Takao, K.; Sasaki, T.; Kozaki, T.; Yanagisawa, Y.; Tadano, K.; Kawashima, A.; Shinonaga, H. Org. Lett. 2001, 3, 4291.
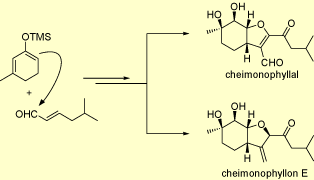
ケイモノフィロン類の全合成
ケイモノフィロン類はCheimonophyllum candidissimumの培養液から単離された抗線虫および抗菌活性を有する一連のビサボラン型セスキテルペノイドであり、ケイモノフィロンAからEおよびケイモノフィラールが存在します。これらのうち、最も複雑な構造を有するケイモノフィロンEおよびケイモノフィラールの不斉全合成を達成しました。
本合成研究は、合成の初期段階で山本尚らの開発した触媒的不斉向山アルドール反応を利用し、99%eeという高いエナンチオ選択性にて不斉中心を構築している点が大きな特徴です。さらに、鍵反応である位置選択的な環化反応を経て、ニ環性骨格を有する共通の中間体を合成した後、ケイモノフィロンEおよびケイモノフィラールの全合成にそれぞれ成功しました。
ref.) 1) Takao, K.; Hara, M.; Tsujita, T.; Yoshida, K.; Tadano, K.; Tetrahedron Lett. 2001, 42, 4665.
2) Takao, K.; Tsujita, T.; Hara, M.; Tadano, K. J. Org. Chem. 2002, 67, 6690.
ケイモノフィロン類はCheimonophyllum candidissimumの培養液から単離された抗線虫および抗菌活性を有する一連のビサボラン型セスキテルペノイドであり、ケイモノフィロンAからEおよびケイモノフィラールが存在します。これらのうち、最も複雑な構造を有するケイモノフィロンEおよびケイモノフィラールの不斉全合成を達成しました。
本合成研究は、合成の初期段階で山本尚らの開発した触媒的不斉向山アルドール反応を利用し、99%eeという高いエナンチオ選択性にて不斉中心を構築している点が大きな特徴です。さらに、鍵反応である位置選択的な環化反応を経て、ニ環性骨格を有する共通の中間体を合成した後、ケイモノフィロンEおよびケイモノフィラールの全合成にそれぞれ成功しました。

ref.) 1) Takao, K.; Hara, M.; Tsujita, T.; Yoshida, K.; Tadano, K.; Tetrahedron Lett. 2001, 42, 4665.
2) Takao, K.; Tsujita, T.; Hara, M.; Tadano, K. J. Org. Chem. 2002, 67, 6690.
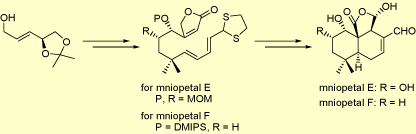
ニオペタール類の全合成
ニオペタール類は、ヒト免疫不全ウイルス(HIV)の逆転写酵素阻害活性を有するドリマン型セスキテルペノイドであり、ニオペタールAからFまでの単離が報告されています。これら一連の化合物は、その抗HIV活性と特異な構造が興味を集め、アメリカ、ドイツなどのグループがその合成研究を行っていましたが、1999年当研究室がニオペタールEの初の全合成を報告しました。その後、2001年にはニオペタールFについても全合成を報告しています。
この合成研究においては、ニオペタール類の酸素官能基および不斉炭素が高度に密集した三環性骨格を、分子内Diels-Alder反応を用いて立体選択的に構築しています。さらに、置換基が異なるニオペタールEおよびFの分子内Diels-Alder反応を通じ、保護基の立体電子効果が反応に与える影響を調べ、報告しています。
ref.) 1) Suzuki, Y.; Nishimaki, R.; Ishikawa, M.; Murata, T.; Takao, K.; Tadano, K. Tetrahedron Lett. 1999, 40, 7835. 2) Suzuki, Y.; Nishimaki, R.; Ishikawa, M.; Murata, T.; Takao, K.; Tadano, K. J. Org. Chem. 2000, 65, 8595. 3) Suzuki, Y.; Ohara, A.; Sugaya, K.; Takao, K.; Tadano, K. Tetrahedron, 2001, 57, 7291.
ニオペタール類は、ヒト免疫不全ウイルス(HIV)の逆転写酵素阻害活性を有するドリマン型セスキテルペノイドであり、ニオペタールAからFまでの単離が報告されています。これら一連の化合物は、その抗HIV活性と特異な構造が興味を集め、アメリカ、ドイツなどのグループがその合成研究を行っていましたが、1999年当研究室がニオペタールEの初の全合成を報告しました。その後、2001年にはニオペタールFについても全合成を報告しています。
この合成研究においては、ニオペタール類の酸素官能基および不斉炭素が高度に密集した三環性骨格を、分子内Diels-Alder反応を用いて立体選択的に構築しています。さらに、置換基が異なるニオペタールEおよびFの分子内Diels-Alder反応を通じ、保護基の立体電子効果が反応に与える影響を調べ、報告しています。

ref.) 1) Suzuki, Y.; Nishimaki, R.; Ishikawa, M.; Murata, T.; Takao, K.; Tadano, K. Tetrahedron Lett. 1999, 40, 7835. 2) Suzuki, Y.; Nishimaki, R.; Ishikawa, M.; Murata, T.; Takao, K.; Tadano, K. J. Org. Chem. 2000, 65, 8595. 3) Suzuki, Y.; Ohara, A.; Sugaya, K.; Takao, K.; Tadano, K. Tetrahedron, 2001, 57, 7291.

